|
固体材料中都有哪些化学键及其特点是?
2021年12月30日 发布
分类:粉体入门 点击量:2590
觉得文章不错?分享到:
|
||||||||
|
材料按状态主要有三态: 气态、液态和固态。液态和固态称为凝聚态。在凝聚态下,原子之间距离很短,产生相互作用力,原子之间便结合在一起,形成了一种结合键。原子结合键是材料的二级结构。材料的性能很大程度上取决于原子间的结合力。结合键共有离子键、共价键、金属键、范德华力和氢键等。可简单分成二大类,结合力强的结合键叫化学键,或称为一次键:如离子键、共价键和金属键;结合力弱的结合键叫物理键(也有将它们看做弱化学力的),或称为二次键。如范德华键和氢键,或称为分子键。 实际材料中原子之间的结合,靠单一键力结合在一起的情况极少,原子间的结合常常是混合键,即化学键中的多种键合形式,有时还有物理键。W、Ta、Pb等一些金属原子凝聚成固体时,其键合方式是金属键和共价键的混合方式。氧化物陶瓷材料除离子键外,也含有相当数量的共价键。 ↓↓四大类材料及其化学键
一、五大类原子结合键 1、金属键:价电子离域共享 所谓金属键主要在金属和合金中存在,处于凝聚状态的金属原子,将它们的价电子贡献出来,作为整个原子基体的共有电子。金属键的基本特征是电子云的共有化,即组成金属晶体的各原子的电子可以在整个晶体中运动。 共有化的电子也称为自由电子,自由电子组成所谓的电子云或电子气,在点阵的周期场中按量子力学规律运动。自由电子的可用性有助于金属成为优良的导体,而失去了价电子的金属原子成为正离子,嵌镶在这种电子云中,并依靠与这些共有化的电子的静电作用而相互结合,这种结合方式就称为金属键。
电子海模型:正原子核被离域电子海(蓝点)包围 电子属于整个“金属大分子”所共有,不再属于哪个原子(电子是离域的) 金属与其他固体的区别是金属中的电子会对外加电场、热梯度以及入射光产生响应。这使得金属具有高的电导率、热导率和光学反射率。金属具有正电阻率温度系数,因此,金属在温度上升时,它的电导性变差。低浓度杂志合金化以后,纯金属的电导率总是下降。如上两种情况对电导率影响的原因是增加了电子的散射,这一作用降低了外加电场方向上电子运动的净分量。还有一个很有趣的现象,金属薄膜与块体之间的电学特性差别很小~~以薄膜形式出现的金属薄膜应用的例子包括集成电路中的触点和互连线,数据存储中的铁磁合金。金属膜也可用于反射镜、光学系统,以及封装材料的装饰与防护涂层和各种元件中。 2、共价键:价电子局域共享 美国化学家路易斯(GNLewis)提出了共价键(covalentbond)的电子理论:原子之间可以通过共用电子使每一个原子都达到稳定的稀有气体电子结构,从而形成稳定的分子。这种原子通过共用电子对而形成的化学键称为共价键。共价键固体是一种强化学键硬质材料,具有较高熔点。周期表中价电子为4个或5个的4A、5A族元素如Si、P等,其离子化相当困难, 只能通过电子共享,在s态、p态角量子壳层达到稳定的8个电子结构。元素周期表末端的元素多以离子键形式存在,而共价键经常在相邻族的元素间形成。 在自然界中,大量的元素和化合物固体是以共价键形式存在的,先进陶瓷和单质分子大多是共价键结合,还有元素半导体Si、Ge、金刚石以及III-V族化合物半导体,如GaAs和InP。
现代电子学中,重要的半导体材料:硅和锗,它们的最外层电子(价电子)都是四个,它们组合成晶体靠共价键结合 3、离子键:价电子转移 由原子间发生电子的转移,形成正负离子,并通过静电引力作用形成的化学键。期表中1A、2A 族金属元素外壳层仅有1-2个价电子,很容易逸出成为正离子如Na、Mg;6A、7A族的非金属原子外壳层为多电子如S、Cl,很容易接受电子成为负离子,成为稳定的电子结构,降低体系能量。这种正负离子的结合属于离子键。离子键的键能较大,故离子化合物的熔点都较高,但当离子键被破坏时,会形成阴阳离子,即在水溶液中或熔融状态下。 TIPS:离子键和共价键没有明显的界限 不过非常值得我们注意的一件事是“离子键和共价键没有明显的界限”,如上的讨论是一种简化了的模型,实际上任何所谓的极性共价键都含有离子键成分,不存在纯粹绝对的离子键,任何离子键都含有原子轨道重叠的成分(即共价键成分)。 不论是离子键还是共价键,均利用的是电子进行成键不同的是,离子键中,以静电力作为支撑通常没有方向性。而共价键来源于共用电子对,具有方向性。电子是一团波是一个概率波,他不是一个单纯的粒子。在空间中以的位置不是固定的,而是存在概率分布。对于共价键来说,电子集中分布在两原子中间。这是有利于能量降低的。然而不可忽视的是,对于共价键,电子依然有概率完全集中在其中的一个原子上而形成离子。这只是一个概率问题。 纯粹的共价键一般来说认为是同原子分子,且没有极性的那种。其电子云密度集中分布在两原子之间。基本上没有离子性。(实际上还是有,但是概率极低完全可以忽略)回到离子键上,虽然阴阳离子之间具有能垒,但是依然存在这么一个概率使得电子形成共用电子对成为共价键。电负性相差越大的阴阳离子其能垒越高,越不容易形成共价键,所以共价成分越低。例如:离子化合物氯化钠晶体中的化学键含有71%的离子键成分和29%的共价键成分;而我们大名鼎鼎的强共价键化合物碳化硅,其共价键成分可达88%。 4、 范德瓦尔兹键(范德华力):分子间的引力 物理键(范德华力及氢键)是由分子之间的静电引力而产生的力,称为分子键。在物理键形成过程中,并没有发生电子得失、电子共有和电子公有化,它是由于分子中电子分布不均匀而引起的分子间引力的结合。范德华键的特点是由分子间偶极吸引力所形成的物理键,其键力远小于化学键,故键合力弱,熔点低,硬度低,材料稳定性差,易变形。范德华键是分子间偶极距所产生的静电吸力将两个分子结合在一起的力。范德华力是分子间力,由三种力组成:取向力(dipole force)、诱导力(induction force)和色散力(dispersion force)。
熔沸点:对于组成和结构相似的分子,相对分子质量越大,物质的熔沸点越高(除H2O、HF、NH3)。例如:烷烃(CnH2n+2)的熔沸点随着其相对分子质量的增加而增加,也是由于烷烃分子之间的范德华力增加所造成的。 溶解度:溶剂与溶质分子间力越大,溶质的溶解度越大。例如:273 K,101 kPa时,氧气在水中的溶解量(0.049 cm3·L-1)比氮气的溶解量(0.024 cm3·L-1)大,就是因为O2与水分子之间的作用力比N2与水分子之间的作用力大所导致的。 在二维层状材料领域,层内以强的共价键或离子键结合而成,而层与层之间依靠弱的范德华力堆叠在一起的一类新型材料。由于层间弱的相互作用力,在外力的作用下,层与层很容易相互剥离,从而可以形成二维层状材料。最典型的例子就是石墨烯。 5、氢键 氢键力是一种由氢原子引起的特殊的分子间相互作用力。它是由氢原子同时与两个电负性很大、原子半径较小的原子(O、F、N)之间的结合所形成的物理键。氢键中的氢原子起关键作用。氢键本质上与范德华键一样,是依靠分子间的偶极吸引力结合在一起,性质相似,但结合力比范德华力大,且具有饱和性和方向性。范德华力的大小会影响物质尤其是分子晶体的熔点和沸点,通常分子的分子量越大,范德华力越大。水(氧化氢)比硫化氢的相对分子质量小,因此范德华力比后者弱,但由于水分子间存在更强的氢键,熔沸点反而更高。
例如:二个水分子间的氢键力
氢键虽然是一种弱键,但由于它的存在,物质的性质出现了反常现象,在形状结构等方面受到了很大的影响。氢键由于广泛存在与化合物中,因此在研究化合物的性能时,氢键起着重要的作用。氢键的键能介于共价键和范德华力之间,其键能小,形成或破坏所需的活化能也小,加上形成氢键的结构条件比较灵活,特别容易在常温下引起反应和变化,故氢键是影响化合物性质的一个重要因素。 氢键在材料领域中应用:液晶材料领域是氢键应用研究较早较多的领域。分子间氢键具有良好的热稳定性,既能使不具有液晶行为的质子给体和受体形成的氢键复合物呈现液晶性,也可改变原质子给体和受体的液晶行为。虽然氢键键能较弱,给其复合物稳定性带来不利影响,但它的适当弱化,反而使得氢键液晶高分子具有独特的动力学性质,尤其是对温度的变化具有可逆响应性能,为其在感应材料制备方面的应用提供了广阔的空间。氢键的动态可逆特性,基于氢键相互作用的超分子液晶体系具有信息储存功能、质量或电荷传输性以及分子传感等诸多动态特性。 二、结合能与材料性能 共价键、离子键的键能大,金属键的键能次之; 范德华键的键能最小,远小于三种化学键的结合能。 不同结合键能的大小
1、熔点 熔点与键能有较好的对应关系。离子键和共价键的化合物熔点高,其中纯共价键的金刚石具有最高的熔点;某些金属如W、Ta等也存在相当部分的共价键,故熔点高;普通金属材料的熔点相对较低。离子键结合能大,故陶瓷材料比金属材料具有更高的热稳定性,耐高温性好。 物理键结合的材料熔点较小,如线性高分子材料,因有大量的物理键,其熔点很低,耐热性较差。
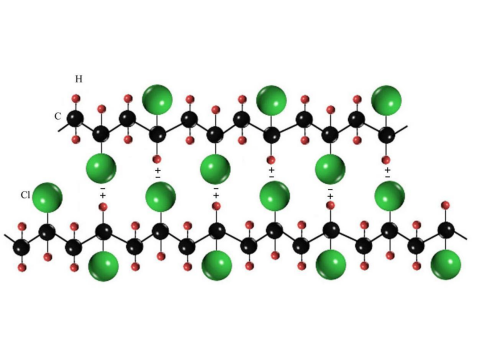
聚氯乙烯(PVC)大分子链之间的氢键力 2、密度 材料的密度与结合键类型关系密切。金属材料如Pb、Ag、Cu 等元素的密度高,这是因为:一是金属原子质量大;二是金属键的结合方式没有方向性,原子趋于紧密排列,得到简单的原子排列形态。 离子键和共价键结合的原子,相邻原子的个数受到共价键数目的限制,离子键结合还要满足正、负离子间电荷之间的平衡,原子不可能紧密堆积,而且存在空洞缺陷,故陶瓷材料密度小。高分子材料的组成元素主要是C、H,质量小,且分子链间是物理键结合,堆积不紧密,密度就更小。 3、导电、导热性 金属键有大量自由电子的运动和离子的振动,使金属材料具有良好的导热性和导电性。陶瓷材料和高分子材料由于无自由电子存在,固态下基本不导电,成为一种绝缘材料。
粉体圈编辑:Alpha 版权声明: 本文为粉体圈原创作品,未经许可,不得转载,也不得歪曲、篡改或复制本文内容,否则本公司将依法追究法律责任。 
相关标签:
相关内容:
|
||||||||